
光谱
1. 定义: 用光栅或棱镜可以把各种颜色的光按波长展开,获得光的波长(频率)和强度分布的记录。
2. 分类:物质的光谱按其产生方式不同可分为两大类:发射光谱和吸收光谱。
(1)发射光谱:物体直接发出的光通过分光后产生的光谱,它可以分为连续谱和线状谱。
① 连续谱:由连续分布的一切波长的光(一切单色光)组成的光谱。
② 线状谱:只含有一些不连续的亮线的光谱。

(2)吸收光谱:高温物体发出的白光通过温度较低的物质时,某些波长的光被该物质吸收后产生的光谱。
3. 特征谱线: 各种原子的发射光谱都是线状谱,且不同原子的亮线位置不同,故这些亮线称为原子的特征谱线。
4. 光谱分析
(1)各种原子都有自己的特征谱线,根据原子的特征谱线分析鉴别物质、确定其组成成分的方法叫做光谱分析。
(2)优点:灵敏度高。样本中元素含量达到 10-10g就可以被检测到。
(3)应用:检查物体的纯度;鉴别和发现元素;天文学上光谱的红移表明恒星的远离等。
(4)光谱分析可以使用发射光谱中的线状谱,也可以使用吸收光谱,因它们都有原子自身的特征谱线,但不能使用连续光谱。
(5)炽热的固体、液体和高压气体发出的是连续光谱,而稀薄气体发射的是线状谱。
5. 太阳光谱
(1)特点:在连续谱的背景上出现一些不连续的暗线,太阳光谱是一种吸收光谱。
(2)解释:阳光中含有各种颜色的光,当阳光透过太阳的高层大气射向地球时,太阳高层大气含有的元素会吸收它自己特征谱线的光,再向四面八方发射出去,到达地球的这些谱线看起来就弱了,形成连续谱背景下的暗线。
(3)意义:分析太阳大气中含有的化学成分;证明物质构成的统一性;为深入原子世界开辟道路。
氢原子光谱的实验规律
1. 光的产生: 许多情况下光是由原子内部电子的运动产生的,因此光谱研究是探索原子结构的一条重要途径。
2. 氢原子光谱:在充有稀薄氢气的放电管两极间加上2kV~3kV的高压,使氢气放电,氢原子在电场的激发下发光,可以获得氢原子光谱。
3. 巴耳末系: 在氢原子光谱图中可见光区内,从右到左的四条谱线中,相邻谱线间的距离越来越小,称为巴耳末系。

4. 巴耳末系公式
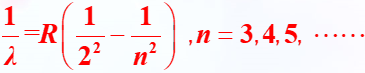
式中:R 为里德伯常量,R = 1.10 × 107m-1;n 为整数。
①巴耳末线系的 4 条谱线都处于可见光区。
②在巴耳末线系中 n 值越大,对应的波长 λ 越短,即n = 3 时,对应的波长最长;n = 6 时,对应的波长最短。
③除了巴耳末线系,氢原子光谱在红外和紫外光区的其他谱线,也都满足与巴耳末公式类似的关系式。
经典理论的困难
1. 经典物理学无法解释原子的稳定性
按经典电磁理论,由于电子绕核运动时不断向外辐射电磁波,电子能量不断减少,电子将逐渐接近原子核,最后落于核上,这样,原子应是一个不稳定系统。但事实并非如此,原子是一个很稳定的系统。
2. 经典物理学无法解释原子光谱的分立特征

按经典电磁理论,电子绕核转动要向周围空间辐射电磁波,电磁波频率等于电子绕核旋转的频率,随着电子运动的轨道半径不断变化,电子辐射的电磁波频率也在不断地变化,因而所呈现的光谱应为连续光谱。然而,事实上原子光谱是由一些不连续的亮线组成的分立的线状谱。
玻尔原子理论的基本假设
1、轨道假设
原子中的电子在库仑力的作用下,绕原子核做圆周运动,服从经典力学的规律。但是,电子轨道半径不是任意的,只有当半径大小符合一定条件时,这样的轨道才是可能的。即电子的轨道是量子化的。 电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射。
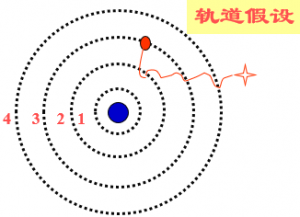
2、能级假设
当电子在不同轨道上运动时,原子处于不同状态,具有不同能量,所以原子能量也是量子化的。
这些量子化的能量值叫能级;原子中这些具有确定能量的稳定状态叫定态。
能量最低的状态叫基态,其他状态叫激发态。
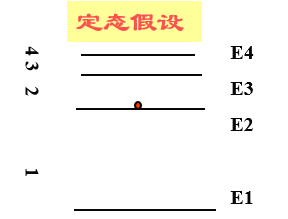
下图是氢原子基态(第一能级)与激发态之间的等量关系:
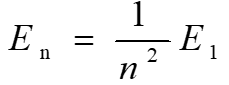
其中En表示第n能级的能量,E1表示基态(第一能级),![]()
3、跃迁假设
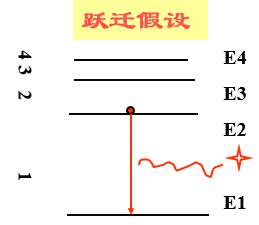
当电子从能量较高的定态轨道(设能量为Em)跃迁到能量较低的定态轨道(设能量为En,m>n)时,它辐射出一定频率的光子,光子的能量由这两种定态的能量差决定,即
![]()
同样的,当电子吸收光子时会从较低的能量态跃迁到较高的能量态,吸收的光子的能量同样由两种定态的能量差决定。

电离:完全脱离原子核束缚,电离条件:hv≥En。电离后电子剩余动能为:![]()
玻尔理论对氢光谱的解释
1. 解释巴耳末系公式
(1)按照玻尔理论,原子从高能级 (如从E3) 跃迁到低能级,(如到E2)时辐射的光子的能量为hν=E3-E2。
(2)巴耳末公式中的正整数n和2正好代表能级跃迁之前和之后所处的定态轨道的量子数n和2。并且理论上的计算和实验测量的里德伯常量符合得很好。
2. 解释气体导电发光
通常情况下,原子处于基态,基态是最稳定的,原子受到电子的撞击,有可能向上跃迁到激发态,处于激发态的原子是不稳定的,会自发地向能量较低的能级跃迁,放出光子,最终回到基态。
3. 解释氢原子光谱的不连续性
原子从较高能级向低能级跃迁时放出光子的能量等于前后两能级差,由于原子的能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线。
4. 解释不同原子具有不同的特征谱线
不同的原子具有不同的结构,能级各不相同,因此辐射(或吸收)的光子频率也不相同。
玻尔理论的局限性
1. 玻尔理论的成就
(1)玻尔理论第一次将量子观念引入原子领域。
(2)提出了定态和跃迁的概念,成功解释了氢原子光谱的实验规律。
2. 玻尔理论的局限性
过多地保留了经典理论,即保留经典粒子的观念,把电子的运动看作经典力学描述下的轨道运动。
3. 电子云
原子中的电子没有确定的坐标值,我们只能描述电子在某个位置出现概率的多少,把电子这种概率分布用疏密不同的点表示时,这种图象就像云雾一样分布在原子核周围,故称电子云。
世界是很奇怪的
高中物理知识点总结
发表回复
要发表评论,您必须先登录。