
热力学第零定律(英语:Zeroth Law of Thermodynamics),又称热平衡定律,是热力学的四条基本定律之一,是一个关于互相接触的物体于热平衡时的描述,并为温度提供了理论基础。最常用的定律表述是:
“ 若两个热力学系统均与第三个系统处于热平衡状态,此两个系统也必互相处于热平衡。”
换句话说,第零定律是指:在一个数学二元关系之中,热平衡是递移的。
热力学第零定律历史
第零定律比起其他任何定律更为基本,但直到二十世纪三十年代前一直都未有察觉到有需要把这种现象以定律的形式表达。第零定律是由英国物理学家拉尔夫·福勒于1939年正式提出,比热力学第一定律和热力学第二定律晚了80余年,但是第零定律是后面几个定律的基础,所以叫做热力学第零定律。
概要
一个热平衡系统的宏观物理性质(压强、温度、体积等)都不会随时间而改变。一杯放在餐桌上的热咖啡,由于咖啡正在冷却,所以这杯咖啡与外界环境并非处于平衡状态。当咖啡不再降温时,它的温度就相当于室温,并且与外界环境处于平衡状态。
两个互相处于平衡状态的系统会满足以下条件:
1、两者各自处于平衡状态;
2、两者在可以交换热量的情况下,仍然保持平衡状态。进而推广之,如果能够肯定两个系统在可以交换热量的情况下物理性质也不会发生变化时,即使不容许两个系统交换热量,也可以肯定互为平衡状态。
因此,热平衡是热力学系统之间的一种关系。数学上,第零定律表示这是一种等价关系。(技术上,需要同时包括系统自己亦都处于热平衡。)
第零定律与温度
第零定律说明任何两个系统的热平衡关系都是等价的,而经常被认为可于建立一个温度函数;更随便的说法是可以制造温度计。而这个问题是其中一个热力学和统计力学哲学的题目。
在热力学变量的空间中,温度为定值的区域可看作一个面,其为邻近的面提供自然的顺序。于是可建立一个连续的总体温度函数。按此定义的温度实际上未必如摄氏温度尺般,而是一个函数。该恒温面的维度是热力学变量的总数减一,例如对于有三个热力学变量 P、 V、n的理想气体,其恒温面是块二维面。若两个均为理想气体的系统处于热平衡,则:
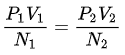
其中, Pi是第 i个系统的压力,Vi是第 i个系统的体积, Ni是第 i个系统的摩尔数或原子数目。
这样,温度相同时 PV/N为一常数,故可引入常数R来定义温度T,使得 PV/N=RT。这样,这种系统可作为温度计较准其他系统,此即为理想气体温度计。
高中物理知识点总结
3 comments