
三大气体实验定律
1、玻意耳定律:PV=C
2、査理定律:P/T=C
3、盖-吕萨克定律:V/T=C
这些定律的适用范围:温度不太低,压强不太大。
理想气体:假设有这样一种气体,它在任何温度和任何压强下都能严格地遵从气体实验定律,我们把这样的气体叫做“理想气体”。
理想气体的特点:
1、理想气体是不存在的,是一种理想模型。
2、在温度不太低,压强不太大时实际气体都可看成是理想气体。
3、从微观上说:分子间以及分子和器壁间,除碰撞外无其他作用力,分子本身没有体积,即它所占据的空间认为都是可以被压缩的空间。
4、从能量上说:理想气体的微观本质是忽略了分子力,没有分子势能,理想气体的内能只有分子动能。
5、一定质量的理想气体的内能仅由温度决定 ,与气体的体积无关。
理想气体的状态方程
1、内容:一定质量的某种理想气体在从一个状态变化到另一个状态时,尽管p、V、T都可能改变,但是压强跟体积的乘积与热力学温度的比值保持不变。
2、公式:
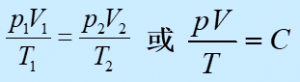
注意:恒量C由理想气体的质量和种类决定,即由理想气体的物质的量决定。
3、使用条件:一定质量的某种理想气体。
例题:
1、如图所示,内径均匀的U形管中装入水银,两管中水银面与管口的距离均为l=10.0 cm,大气压强p0=75.8 cmHg时,将右侧管口封闭,然后从左侧管口处将一活塞缓慢向下推入管中,直到左右两侧水银面高度差达h=6.0 cm为止.求活塞在管内移动的距离。(答案:6.4 cm)

2、如图所示,一定质量的理想气体,由状态A沿直线AB变化到B,在此过程中,气体分子的平均速率的变化情况是(D )
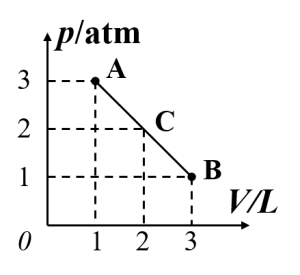
A、不断增大 B、不断减小
C、先减小后增大 D 、先增大后减小
高中物理知识点总结
老师有气体微观压强的归纳吗?就是关于气体分子单位时间内对单位面积器壁的碰撞次数,平均撞击力,分子数有啥关系,想看