
经典物理学既无法解释原子的稳定性,又无法解释原子光谱的分立特征,这时就需要新的理论,波尔在普朗克关于黑体辐射的量子论和爱因斯坦关于光子概念的启发下,于1913年把微观世界中物理量取分立值的观念应用到原子系统,提出了自己的原子结构假说。
玻尔原子理论的基本假设
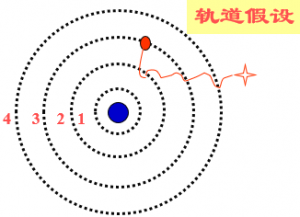
1、轨道假设
原子中的电子在库仑力的作用下,绕原子核做圆周运动,服从经典力学的规律。但是,电子轨道半径不是任意的,只有当半径大小符合一定条件时,这样的轨道才是可能的。即电子的轨道是量子化的。 电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射。
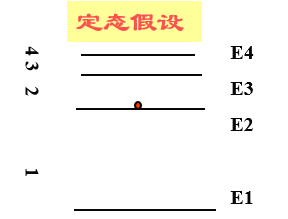
2、能级假设
当电子在不同轨道上运动时,原子处于不同状态,具有不同能量,所以原子能量也是量子化的。
这些量子化的能量值叫能级;原子中这些具有确定能量的稳定状态叫定态。
能量最低的状态叫基态,其他状态叫激发态。
下图是氢原子基态(第一能级)与激发态之间的等量关系:
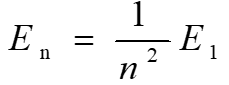
其中En表示第n能级的能量,E1表示基态(第一能级),![]()
3、跃迁假设
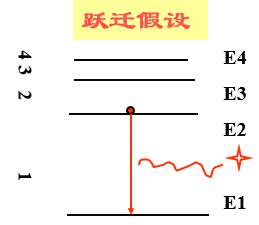
当电子从能量较高的定态轨道(设能量为Em)跃迁到能量较低的定态轨道(设能量为En,m>n)时,它辐射出一定频率的光子,光子的能量由这两种定态的能量差决定,即
![]()
同样的,当电子吸收光子时会从较低的能量态跃迁到较高的能量态,吸收的光子的能量同样由两种定态的能量差决定。

电离:完全脱离原子核束缚,电离条件:hv≥En。电离后电子剩余动能为:![]()
玻尔模型的局限性
玻尔理论解决了原子的稳定性和辐射的频率条件问题,但是也有它的局限性。除了氢原子光谱外,在解决其他问题上遇到了很大的困难。如氦原子光谱玻尔理论解决不了,波尔理论还没有完全解释微观粒子运动的规律。
高中物理知识点总结
发表回复
要发表评论,您必须先登录。